Aktuelle Forschung
Der Schwerpunkt der wissenschaftlichen Arbeiten in meinem Labor liegt auf der Erforschung der molekularen Mechanismen, die der mitochondrialen Protein-Homöostase zugrunde liegen. Wir sind in erster Linie an der Anwendung dieser biochemischen Erkenntnisse auf die Aufklärung der pathologischen Prozesse bei neurodegenerativen Erkrankungen wie Morbus Parkinson oder Alzheimer interessiert. Im besonderen Fokus unserer Forschung steht dabei ein Protein, das für die mitochondriale Protein-Qualitätskontrolle verantwortlich ist.
Mitochondrien – wichtig für essenzielle Prozesse
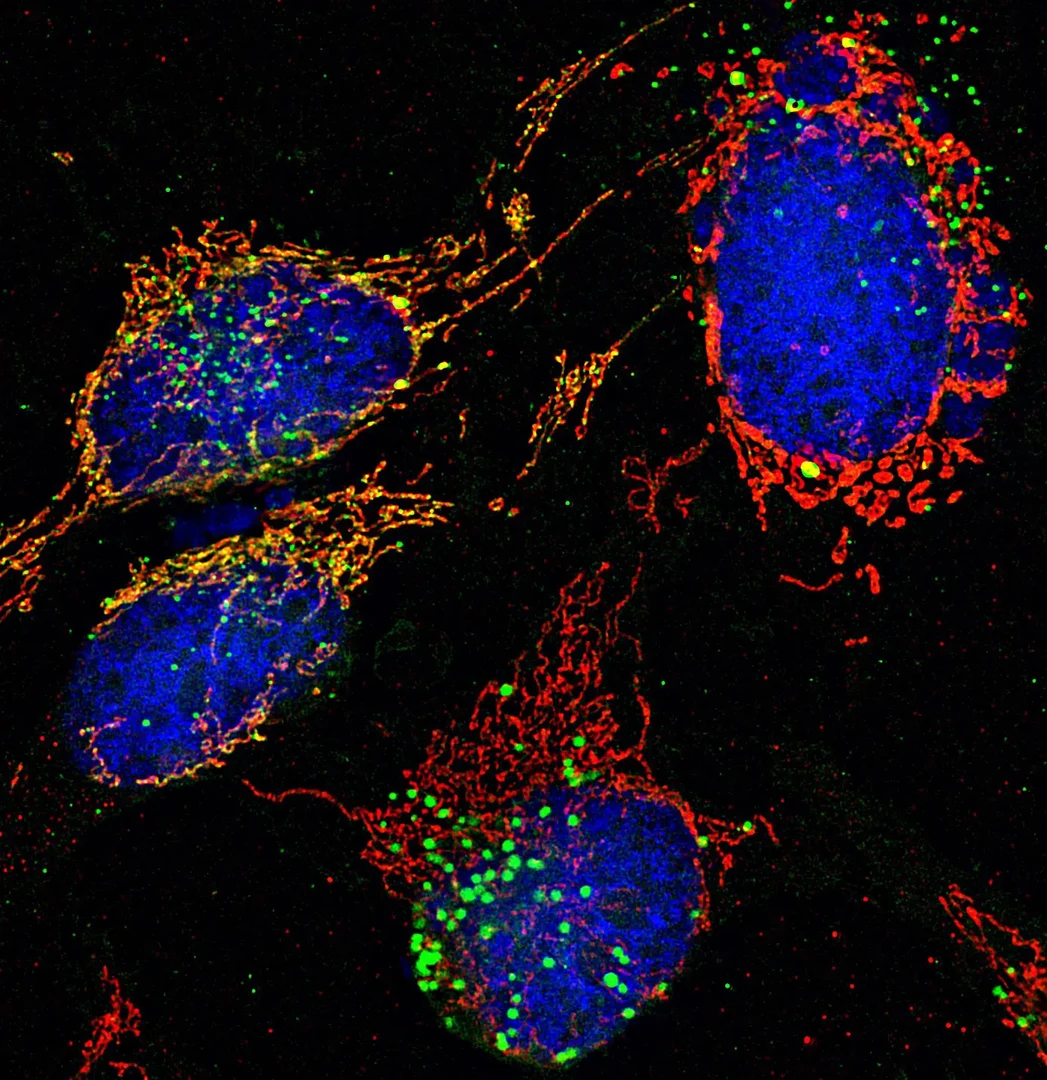
Mitochondrien sind essenzielle Komponenten einer eukaryontischen Zelle. Neben der Erzeugung des Hauptanteils zellulären ATPs, werden Mitochondrien für viele essenzielle biosynthetische Prozesse benötigt und sind zudem an wichtigen Signalprozessen wie der Apoptose beteiligt. Die Aufrechterhaltung der mitochondrialen Proteinfunktionen unter normalen und pathologischen Bedingungen (»Protein-Homöostase«) ist daher essenziell für das Überleben der eukaryontischen Zelle. Neben einem entscheidenden Einfluss auf Alterungsprozesse spielen Defekte mitochondrialer Prozesse bei vielen Krankheiten eine wichtige Rolle, insbesondere bei neurodegenerativen und Tumor-Erkrankungen.
Defekte Mitochondrien
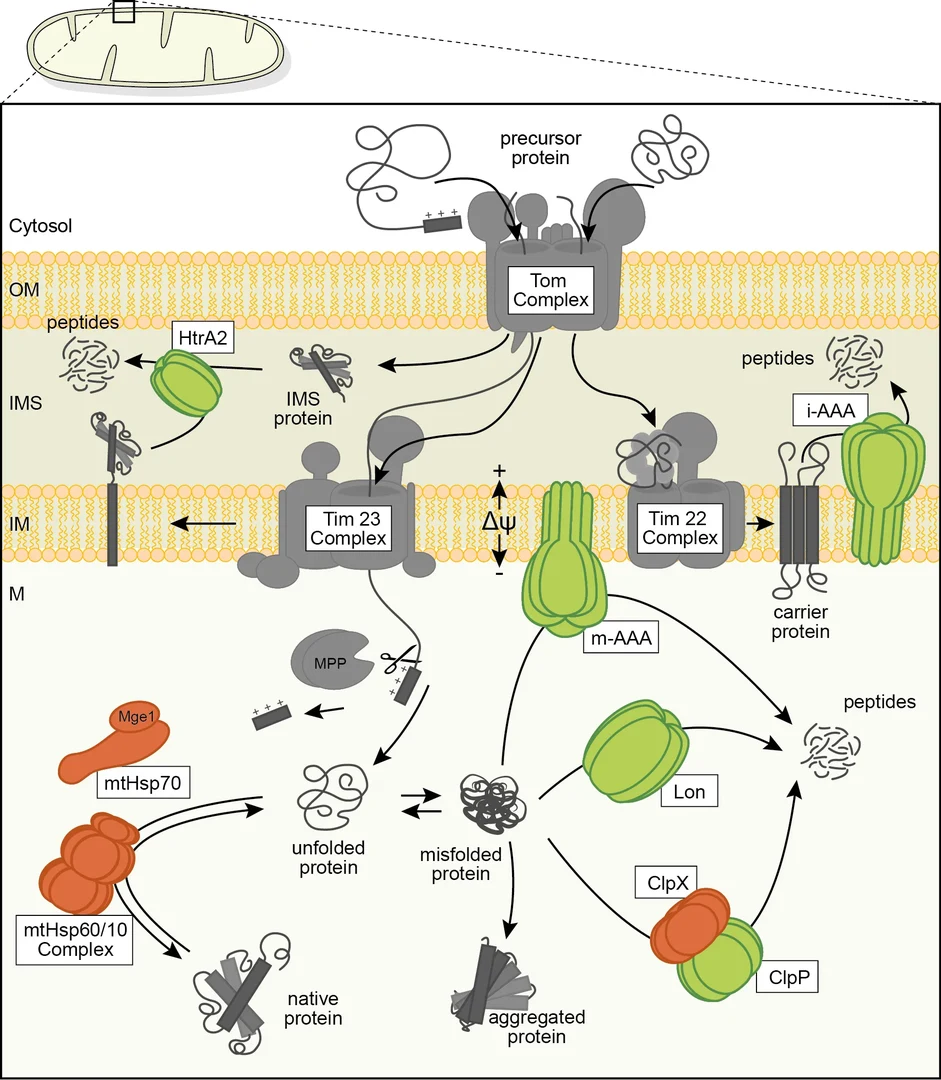
Primär werden Schutz- und Reparaturfunktionen für beschädigte Proteine von einem funktionalen Netzwerk von Faltungshelferproteinen (Chaperone) und ATP-abhängigen Proteasen übernommen. Die mitochondrialen Chaperone der Hsp70- und Hsp60-Famile besitzen in einer ATP-regulierten Reaktion eine hohe Affinität zu ungefalteten und überwiegend hydrophoben Polypeptidsegmenten. Durch Bindung werden derartige Substratproteine stabilisiert und können zur aktiven Form zurückgefaltet werden. Terminal geschädigte oder komplett denaturierte Proteine müssen von speziellen Proteasen im Matrix-Kompartiment und der Innenmembran erkannt und entfernt werden, bevor sie durch Aggregation zu zellulären Schäden beitragen können. Falls es durch eine Überlastung des Chaperon/Protease-Systems doch zu Proteinaggregation kommen sollte, zeigen neueste Ergebnisse, dass diese Aggregate in speziellen mitochondrialen Kompartimenten, IMiQ für »intramitochondrial quality control compartment« abgelagert und neutralisiert werden. Neurodegenerative Krankheiten zeigen häufig eine Akkumulation defekter Mitochondrien. Neben den oben beschriebenen Prozessen werden neuartige Mechanismen der Qualitätskontrolle postuliert, die auf molekularer Ebene noch weitgehend unverstanden sind und von der Arbeitsgruppe aktiv studiert werden.
Die Rolle von Mitochondrien bei human-pathologischen Prozessen
Zur Aufklärung dieser Mechanismen wird ein weites Spektrum an biochemischen und zellbiologischen Arbeitsmethoden am Modellorganismus Saccharomyces cerevisiae (Bierhefe) und in humanen Zellkultur-Systemen angewandt. Dazu wurden spezifische Techniken etabliert, um mitochondriale Degradations- und Aggregationsreaktionen zu charakterisieren. Zudem wird durch Anwendung von Techniken der Proteom-Analyse der qualitative und quantitative Proteindurchsatz durch das System der Protein-Qualitätskontrolle bestimmt. Dabei geht es in erster Linie um die Identifizierung des natürlichen Substratspektrums der mitochondrialen Chaperone und Proteasen und um die Definition ihrer Substratselektivität, die im Fall der Mitochondrien – im Gegensatz zum Ubiquitin-Proteasomsystem des Cytosols – nicht auf einer speziellen Markierung von Substratproteinen beruht. Die gewonnenen Erkenntnisse werden die Basis für eine Charakterisierung der Rolle von Mitochondrien bei human-pathologischen Prozessen darstellen.
Offene Stellen
Aufgrund der interdisziplinären Arbeitsweise des Labors sind Absolvent*innen der Studiengänge Biochemie, Biologie, Biomedizin und Medizin als Mitarbeiter*innen willkommen. Die wissenschaftlichen Arbeiten werden durch die Deutsche Forschungsgemeinschaft gefördert.


